Con lo sviluppo di nuovi vaccini per combattere la pandemia di Coronavirus Disease 2019 (COVID-19) in corso, mirati all’agente patogeno, sindrome respiratoria acuta grave, Coronavirus 2 (SARS-CoV-2), è stato pubblicato un nuovo documento di ricerca pre-stampa sopra bioRxiv* Il server descrive un nuovo vaccino su scala nanometrica di subunità che sembra avere una forte immunità e un’attività equivalente.
Nuovi approcci ai vaccini basati su picchi
Sia l’antigene virale spike che il dominio di legame del recettore (RBD), che produce potenti anticorpi equivalenti al virus, sono stati usati per produrre la maggior parte dei vaccini attualmente in uso e in fase di sviluppo. La RBD è più pronunciata e più stabile della proteina spike a lunghezza intera, ma quest’ultima è più immune.
Tuttavia, i nuovi approcci all’assemblaggio RBD hanno notevolmente migliorato la sua capacità di indurre una risposta equivalente. Uno di questi esempi è l’induzione dell’autoassemblaggio RBD per formare particelle simili a virus (VLP).
Il presente studio mira a migliorare l’immunità cellulare e adattativa indotta da RBD virale perché le cellule T CD4 + e CD8 + sono fondamentali per la clearance virale e le risposte immunitarie delle cellule di memoria all’immunità a lungo termine.
In secondo luogo, lo studio cerca di confrontare l’efficacia dei gruppi di nanoparticelle con i vaccini più tradizionali.
Polimersomi con presentazione dell’antigene RBD
I ricercatori si sono basati sulla loro precedente esperienza con i polimeri (PS), che sono corpi autoassemblanti realizzati dal blocco di copolimero poli (glicole etilenico) -bull poli (PEG-PPS). Si è dimostrato efficace nel fornire un antigene e un aiutante agli endosomi delle cellule dendritiche. Queste sono le cellule immunitarie innate che presentano gli antigeni alle cellule immunitarie che rispondono al sistema immunitario adattativo.
All’interno degli endosomi, il PPS subisce l’ossidazione e quindi il PS forma invece delle micelle, con conseguente rilascio di un antigene avvolgente o altra carica. Il risultato è stata l’attivazione delle cellule dendritiche, una risposta robusta delle cellule T e titoli elevati di anticorpi multi-vettore.
I ricercatori hanno tentato di migliorare la risposta anticorpale agli antigeni trasmessi dal PS senza sacrificare la risposta immunitaria cellulare modulandola in un modo che assomigli alla forma delle particelle virali, visualizzando al contempo multipli dell’antigene bersaglio.
La speranza era che questo display RBD polivalente migliorasse le proprietà di reticolazione e blocco dei recettori delle cellule B (BCR) per indurre livelli più elevati di anticorpi neutralizzanti.
In questo studio, la PS è stata valutata sia con RBD legato alla superficie che con RBD rivestito utilizzando PS MPLA rivestito con A monofosforo A rivestito di lipidi (MPLA).
I ricercatori hanno prodotto il vaccino nanofiltrato accoppiando antigeni spike alla superficie del PS, utilizzando una piattaforma versatile N3-PEG-PPS che può essere adattata a qualsiasi antigene. Possono essere raggruppati per formare particelle di PS con più gruppi funzionali sulla superficie in grado di fornire l’antigene desiderato, in questo caso il picco RBD.

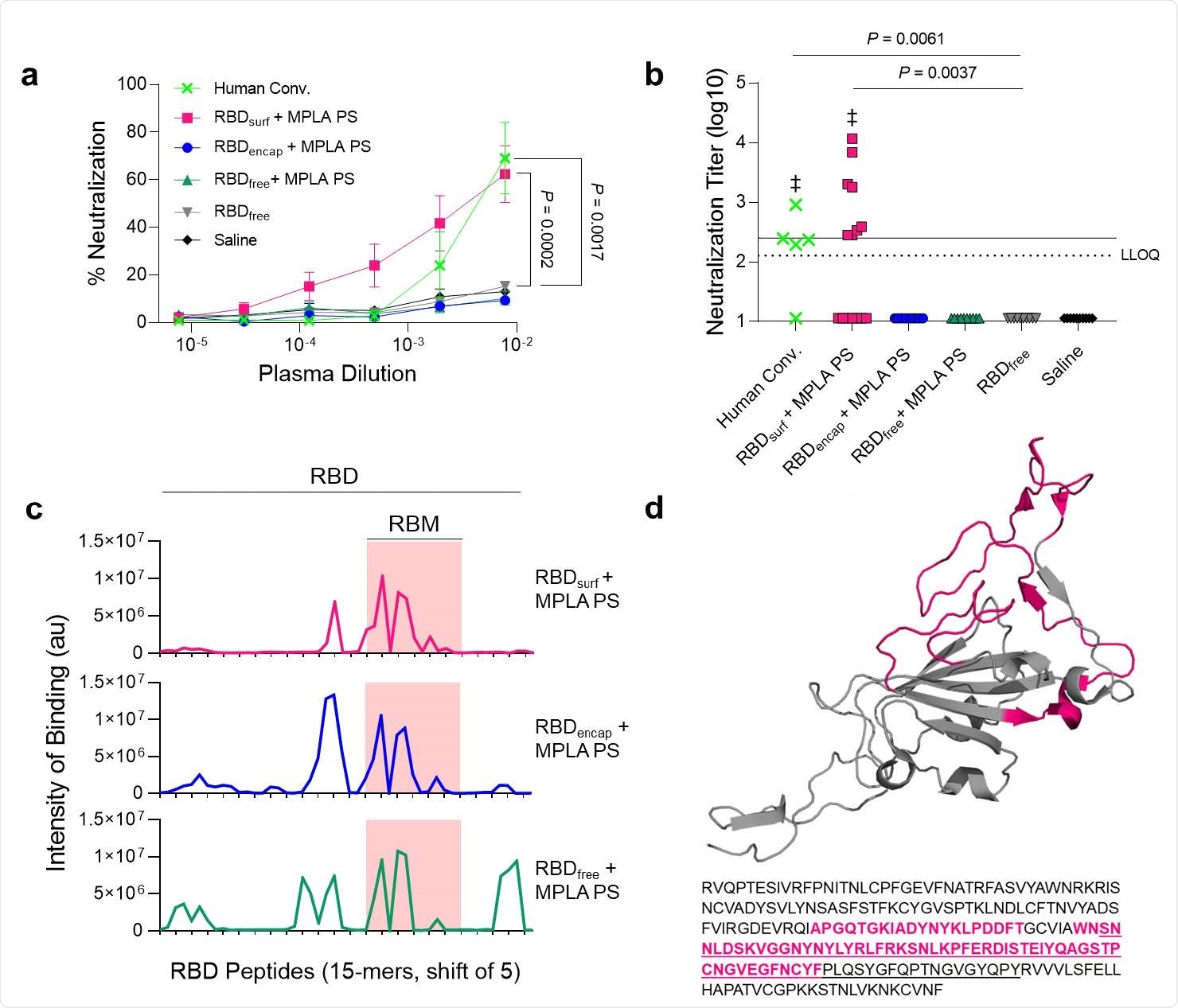
Gli anticorpi generati dall’innesto vengono neutralizzati con RBDsurf + MPLA PS e localizzati nella forma di legame del recettore. R, Il plasma prelevato dai topi è stato testato 1 settimana dopo il potenziamento per la sua capacità di neutralizzare l’infezione SARS-CoV-2 delle cellule Vero E6 in vitro. Equazione della percentuale di diluizioni plasmatiche multiple normalizzate in cellule prive di virus (100%) o senza plasma (0%). I dati sono stati tracciati come media ± SEM di n = 5 campioni umani convalescenti (trasformazione umana) o 10-15 topi. Sono stati effettuati confronti con RBD non accompagnato con diluizione minima (10-2.11) utilizzando ANOVA unidirezionale con il post-test di Dunnett. B, Titoli neutralizzanti virali, che rappresentano la diluizione plasmatica poiché il 50% della morte cellulare mediata da SARS-CoV-2 viene neutralizzato. Linea tratteggiata: limite inferiore per la quantificazione (LLOQ = 2.11). Per i valori al di sotto del LLOQ, sono stati tracciati i valori LLOQ / 2. Linea continua: raccomandazione FDA per una valutazione “titolo elevato” (= 2,40). I confronti sono stati effettuati utilizzando il test non parametrico di Kruskal-Wallis con il test post-test di Dunn o il test di classificazione del sito di Wilcoxon (‡ ns, P> 0,05 rispetto al valore predefinito di 2,40). Le icone rappresentano i singoli topi. C, il plasma in pool è stato quindi testato per il legame di anticorpi a circuiti lineari utilizzando peptidi di 15 amminoacidi interlacciati con offset di 5 amminoacidi, coprendo l’intera sequenza RBD. L’asse X rappresenta il numero della sequenza peptidica all’interno della sequenza amminoacidica RBD e l’asse y rappresenta la luminescenza media di ciascun epitopo peptidico. D, Struttura tridimensionale del RBD con il modello di legame del recettore (RBM) che evidenzia e sequenzia il principale peptide riconosciuto dal plasma di topo rosa (Protein Data Bank Entry 7DDD).
Il PS, che incapsula l’RBD, è stato anche formulato insieme a quello che incapsula l’adiuvante MLPA. Hanno confermato la continuazione dell’attività biologica nel RBD coniugato, con un’elevata affinità di legame per il recettore della cellula ospite, l’enzima di conversione dell’angiotensina 2 (ACE2). Al contrario, il PS non legato non riesce a collegarsi con il recettore.
È stato confermato che l’adiuvante utilizzato, MPLA, migliora le vie proinfiammatorie e attiva le cellule presentanti l’antigene (APC).
Surface-RBD PS
Quando sono stati testati in studi preclinici, i risultati hanno mostrato che i topi vaccinati con due dosi della formulazione di visualizzazione della superficie RBD hanno sviluppato un titolo elevato di anticorpi equivalente a SARS-CoV-2, insieme a robuste risposte del centro microbico che indicano l’attivazione delle cellule B e CD4 + e CD8 + Immunità ai linfociti T.
La risposta anticorpale è iniziata meno di una settimana dopo la prima dose ed è stata massima con la formulazione rivestita RBD. I livelli sono rimasti stabili o aumentati lentamente fino alla dose boost, a quel punto sono aumentati di 1,3-1,6 volte.
IgG1 ha dominato la risposta anticorpale di superficie RBD, rispetto a IgG2 e IgG3, che indicavano anche una risposta sbilanciata Th2, mentre era più bilanciata con la forma avvolta.
Gli anticorpi IgA sono stati rilevati in tutti i gruppi adiuvanti, che sono essenziali per la produzione dell’immunità della mucosa.
Gli anticorpi neutralizzanti sono stati stimolati dall’antigene RBD coniugato in modo più efficace, come dimostrato da un test basato su cellule, con un titolo di neutralizzazione virale elevato (VNT): il 50% delle cellule sopravvive dopo il challenge virale.
La capacità di neutralizzazione sembra essere equivalente a quella di un plasma convalescente di alto calibro.
PS RBD laminato
Al contrario, l’antigene RBD avvolgente ha mostrato un riconoscimento efficiente su una gamma più ampia di cicli lineari. Tuttavia, se utilizzata insieme, la combinazione ha prodotto un titolo più elevato di anticorpo Ig (Ig) G diretto dal RBD ma senza aumentare significativamente l’attività di neutralizzazione oltre i livelli basali.
La ragione sembra essere che gli anticorpi RBD legati alla superficie si legano con un alto grado di affinità ai loop all’interno del modello di legame del recettore specifico per RBD (RBM), ma il RBD incapsulato produce anticorpi con una maggiore diversità epitopica al di fuori del RBM.
L’effetto di MPLA
Una volta aggiunto l’adiuvante, tutti i gruppi hanno mostrato cellule T helper follicolari più elevate nei linfonodi che drenano il sito di iniezione una settimana dopo la vaccinazione, con segni di attivazione.
I topi che hanno ricevuto i vaccini adiuvanti hanno anche mostrato prove di una più forte attivazione della linea germinale. Ciò è correlato al cambio di classe e alla differenziazione tra plasmacellule a lunga vita e cellule di memoria cambiando categorie con elevata affinità per l’antigene bersaglio o plasma a vita breve e cellule IgM di memoria.
All’interno di una comunità di cellule B con specificità RBD, è stata osservata una risposta migliore con un vaccino RBD coniugato in superficie.
Non solo questi topi mostrano risposte anticorpali specifiche robuste, ma anche risposte delle cellule T CD4 + e CD8 + con una deviazione Th1 più elevata rispetto a quelli che hanno ricevuto RBD libero, con o senza l’adiuvante.
La superficie del display ha superato il PS RBD
“Le differenze nelle risposte immunitarie evocate dalle due formule dell’antigene PS indicano che la presentazione superficiale dell’antigene porta a risposte più forti al GC, mentre l’antigene PS incapsulato suscita maggiormente una risposta extra-follicolare. “
La risposta GC è preferita rispetto alle risposte extra-follicolari in quanto si traduce in cellule B con maggiore affinità e una risposta immunitaria più permanente. I fattori responsabili della risposta anticorpale più efficace includono l’esposizione multilivello dell’antigene RBD insieme alla sua elevata esposizione ai linfociti B.
La direzione della risposta immunitaria Th1 osservata qui è probabilmente dovuta all’adiuvante utilizzato in questo vaccino candidato e predice un minor rischio di eventi avversi correlati al vaccino.
Quali sono gli effetti?
La presentazione polimerica si traduce in una migliore presentazione dell’antigene delle cellule CD8 + T. Innanzitutto, queste molecole di nanotrasmettitori prendono di mira questo vettore, progettato per catturare particelle impermeabili alla membrana, mediante microcitosi.
In secondo luogo, gli endosomi rilasciano l’antigene in modo più efficiente, specialmente con RBD PS incapsulato. Questi rilasciano facilmente l’antigene con un basso livello di ossidazione, senza acidificazione.
Sia l’adiuvante che l’antigene possono essere erogati sulla stessa particella PS.
Entrambi i tipi di PS portatori di RBD erano stabili per 6 mesi o più a 4 ° C, rendendoli ideali per la distribuzione di vaccini su larga scala in contesti con poche risorse. Inoltre, un singolo PS può essere utilizzato per legare più antigeni dello stesso virus o di virus diversi per suscitare anticorpi neutralizzanti reattivi.
L’uso di antigeni nelle formulazioni di PS potrebbe essere utile nella progettazione di futuri vaccini in cui sono necessarie risposte delle cellule T, compresi i vaccini contro il cancro e quelli antivirali come l’epatite C e l’HIV.
*Nota importante
bioRxiv Pubblica rapporti scientifici preliminari che non sono stati sottoposti a revisione paritaria e quindi non dovrebbero essere considerati conclusivi, indirizzando la pratica clinica / comportamenti relativi alla salute o trattati come informazioni statiche.

“Fan zombi sottilmente affascinante. Fanatico della TV. Creatore devoto. Amico degli animali ovunque. Praticante del caffè.”