.jpg)
La malattia da coronavirus 2019 (COVID-19), causata dalla sindrome respiratoria acuta grave coronavirus 2 (SARS-CoV-2), ha causato un’emergenza sanitaria globale. La longevità dell’immunità alla SARS-CoV-2 dopo l’infezione naturale può avere effetti significativi sulla vitalità dell’immunità indotta dal vaccino.
Il genoma SARS-CoV-2 codifica per quattro principali proteine strutturali: proteina spike (S), nucleoproteina (N), proteina di membrana (M) e proteina dell’involucro (E). La produzione di anticorpi neutralizzanti che mirano specificamente al dominio di legame del recettore (RBD) della proteina S è essenziale per controllare l’infezione da SARS-CoV-2. Tuttavia, gli anticorpi circolanti derivati dalle plasmacellule diminuiscono nel tempo, ma la memoria immunitaria a lungo termine può persistere nelle cellule B della memoria.
Le mutazioni nella subunità S1 possono causare cambiamenti nella struttura della proteina S e dell’RBD e aumentare il legame del virus al recettore. Ciò può comportare un aumento del rischio e della gravità della trasmissione della malattia, nonché una ridotta capacità di neutralizzazione da parte degli anticorpi.
Un nuovo studio è stato pubblicato in bioRxiv* Il server preprint ha seguito la risposta immunitaria adattativa nei pazienti convalescenti delle coorti svedesi e italiane, che in precedenza avevano mostrato risposte immunitarie adattative di lunga durata al ceppo G614, per 15 mesi. Qui, i livelli di anticorpi specifici e i titoli di anticorpi neutralizzanti sono stati testati contro le varianti preoccupanti (VOC).
studiando
In tutto, sono stati raccolti 188 campioni di siero o plasma da 136 pazienti COVID-19 – 98 dall’Italia e 38 dalla Svezia, che avevano una malattia da lieve a grave. È stato anche analizzato il plasma di 108 controlli negativi storici. Titoli plasmatici di anti-RBD e anti-S.
I risultati hanno mostrato che al picco della risposta anticorpale, le immunoglobuline anti-RBD (Ig) M e IgA erano aumentate rispettivamente nel 77% e nell’85% dei pazienti convalescenti. Tuttavia, è diminuito rapidamente da 1-3 mesi ed è stato rilevato in meno del 4,5% e nell’11% dei pazienti testati tra 6 e 15 mesi.
Mentre le proteine IgM e IgA anti-S sono state rilevate rispettivamente nell’88% e nel 90% dei pazienti convalescenti a 15-28 giorni di età, ma in meno del 23% dei pazienti dopo 6-15 mesi. Le emivite degli anticorpi IgM RBD e S-specifiche sono state dedotte rispettivamente di 55 e 65 giorni e l’età degli anticorpi IgA RBD e S-specifiche è stata rispettivamente di 56 giorni e 55 giorni.
Nel frattempo, gli anticorpi IgG plasmatici associati a SARS-CoV-2 RBD e proteina S sono aumentati nel 94% dei partecipanti convalescenti COVID-19 a 15-28 giorni dall’insorgenza dei sintomi. I titoli medi sono diminuiti gradualmente meno di 4 volte, dal picco di risposta anticorpale, fino a sei mesi. Successivamente, sono rimasti coerenti fino a 15 mesi.
Le emivite delle risposte anticorpali RBD e anti-S IgG erano rispettivamente di 134 e 113 giorni, che erano più brevi nei pazienti con malattia lieve o moderata rispetto a quelli con malattia grave o critica. È stato anche riscontrato che il titolo anticorpale IgG specifico è stato stabilizzato dopo sei mesi.
Inoltre, i titoli di RBD plasmatico e di anticorpi IgG specifici per IgG, 14-35 giorni dopo una singola dose di vaccino, erano simili a quelli 6 mesi dopo l’infezione. Mentre le risposte dopo la seconda dose di vaccino corrispondevano a quelle osservate al picco della risposta anticorpale nei pazienti convalescenti.
È stato inoltre riscontrato che la suscettibilità agli anticorpi neutralizzanti persisteva più a lungo nei pazienti affetti da malattie gravi o gravi. Tra 9 e 15 mesi dopo l’infezione, la maggior parte dei campioni ha suscitato un’attività equivalente contro tutti i ceppi; Tuttavia, la proporzione era inferiore per il ceppo Gamma.
I risultati hanno indicato che la risposta anticorpale SARS-CoV-2 e l’attività di neutralizzazione sono diminuite per circa sei mesi dopo l’infezione. Sebbene in proporzioni inferiori, l’attività di neutralizzazione contro le varianti Beta, Gamma e Delta viene solitamente mantenuta fino a 15 mesi dopo l’infezione.
Al contrario, le cellule B che producono IgG specifiche per RBD sono state mantenute in numero relativamente elevato in tutti i pazienti che sono stati seguiti tra 6 e 15 mesi dopo l’infezione. Tuttavia, la gravità e la durata della risposta delle cellule B non dipendevano dalla gravità della malattia.
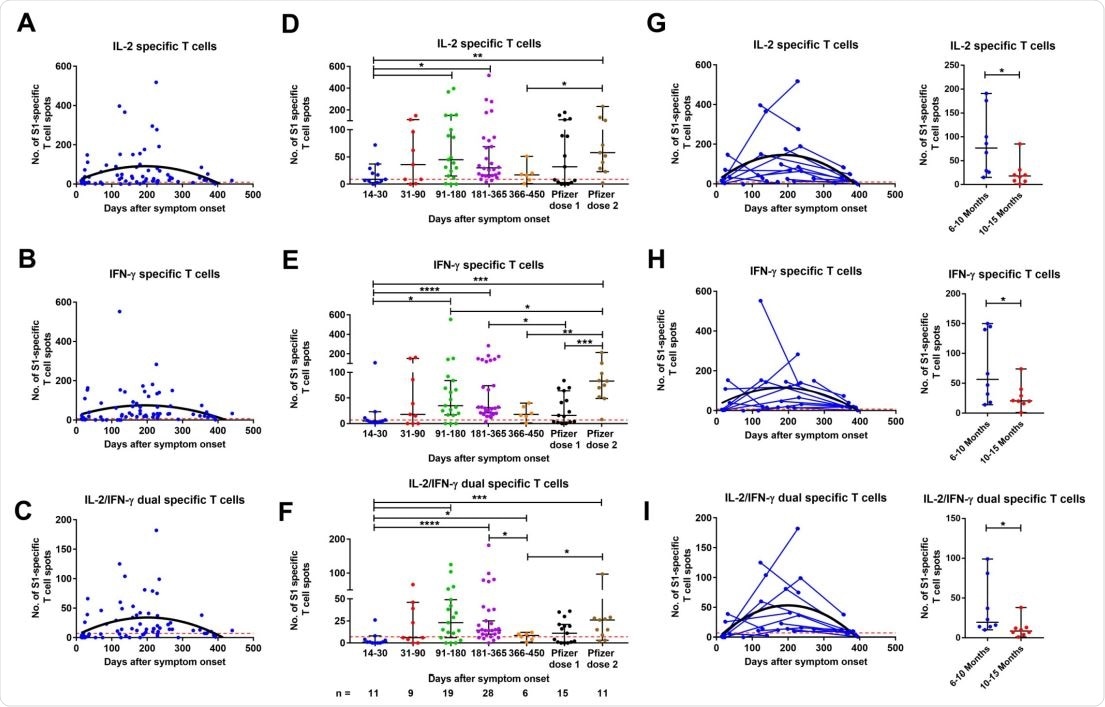
Inoltre, è stato osservato un picco nella risposta delle cellule T tra 3 e 6 mesi dopo l’infezione, seguito da una diminuzione significativa a 12-15 mesi.
deduzione
La persistenza del titolo RBD-IgG nel tempo indica la generazione di plasmacellule a vita lunga. Inoltre, i risultati hanno indicato che gli anticorpi IgG specifici per SARS-CoV-2 possono essere presenti per un tempo più lungo in alcuni individui.
Gli anticorpi neutralizzanti funzionali specifici per SARS-CoV-2 – anti-S e RBD sono essenziali per la neutralizzazione del virus e l’eliminazione virale. Il grado di protezione può dipendere dalla risposta immunitaria iniziale alla sensibilizzazione virale e dalla generazione di cellule di memoria B e T. Inoltre, le cellule di memoria B e T circolanti e gli anticorpi neutralizzanti sono presenti nella maggior parte dei pazienti convalescenti fino a 15 mesi dopo l’infezione da SARS- CoV-2.
Recenti studi hanno dimostrato che i vaccini Pfizer-BioNTech e AstraZeneca erano meno efficaci nel prevenire infezioni o malattie gravi del ceppo Delta rispetto ad altri ceppi. Inoltre, anche l’immunità sviluppata durante le precedenti ondate di infezione potrebbe non essere completamente protettiva contro la reinfezione da delta e altri VOC. Pertanto, i pazienti convalescenti beneficiano della vaccinazione.
Nonostante le risposte immunitarie rapide e robuste negli individui naturalmente infetti dopo due dosi di vaccinazione, sono necessari ulteriori studi sulla longevità di questa immunità.
*Nota importante
bioRxiv Pubblica rapporti scientifici preliminari che non sono stati sottoposti a revisione paritaria e pertanto non devono essere considerati conclusivi, guidare la pratica clinica/comportamenti relativi alla salute o essere trattati come informazioni consolidate.