L’OER è importante in molti processi di energia pulita come la conversione dell’anidride carbonica in combustibili liquidi utilizzabili e la generazione di idrogeno verde dall’elettrolisi dell’acqua. Entrambi i processi saranno cruciali in un futuro senza combustibili fossili. Pertanto, una comprensione completa delle OER è un importante obiettivo di ricerca.
I processi catalitici possono essere complessi con diversi intermedi coinvolti nella transizione dalla materia prima al prodotto desiderato. Le tecniche di attuazione consentono di studiare questi intermedi utilizzando la spettroscopia durante la reazione, fornendo una finestra su ciò che sta realmente accadendo.
Utilizzando un elettrodo superficiale di ossido di iridio, i ricercatori hanno studiato l'ossidazione delle molecole d'acqua in soluzioni con diversi valori di pH.
“L’interazione tra la superficie dell’elettrodo e il mezzo ossigenato è fondamentale per l’efficienza dell’OER, quindi l’ottimizzazione del catalizzatore è stata generalmente l’obiettivo”, spiega l’autore senior Reshma R Rao dell’Imperial College di Londra. “Tuttavia, le osservazioni fino ad oggi hanno lasciato domande senza risposta, quindi abbiamo esaminato più da vicino il lato della soluzione dell’interfaccia utilizzando la spettroscopia UV e visibile, la spettroscopia di assorbimento dei raggi X e la spettroscopia a infrarossi potenziata dalla superficie”.
Per ottenere una reazione efficace, il legame degli intermedi di reazione all'elettrodo deve essere giusto per consentire agli intermedi di reagire con l'elettrodo, ma non così forte da attaccarsi all'elettrodo e non poter reagire. I ricercatori hanno scoperto che il legame è controllato da interazioni a lungo raggio tra gli intermedi all'interno della soluzione e che ciò dipende dal pH.
In condizioni alcaline, l’acqua vicino all’elettrodo influenzava le interazioni a lungo raggio tra le specie ossigenate, influenzandone l’attaccamento alla superficie. Pertanto, sebbene gli intermedi si leghino più fortemente a pH più elevati, le interazioni facilitate dall'acqua interfacciale destabilizzano le specie ossigenate e consentono la reazione.
“L’uso della spettroscopia e di tecniche complementari per dare uno sguardo diretto alle specie coinvolte ci ha permesso di ampliare la comprensione delle prestazioni del catalizzatore oltre il legame degli elettrodi”, afferma l’autore principale Yu Katayama. “Crediamo che tale intuizione sarà fondamentale per migliorare la mobilità delle OER”.
I risultati contribuiranno ad aumentare l’efficienza dell’ossidazione dell’acqua per produrre idrogeno verde. Inoltre, combinare la spettroscopia di processo con tecniche complementari può essere utile per comprendere la catalisi di molti altri processi.
Figura 1: Schema dell'interfaccia elettrochimica con elettrolita acido HClO4 da 0,1 M (A) e elettrolita alcalino 0,1 M KOH (B) durante l'ossidazione dell'acqua a ~ 1,5 VRHE.
Fonte: adattato dal Journal of the American Chemical Society, 2024, DOI: 10.1021/jacs.3c12011
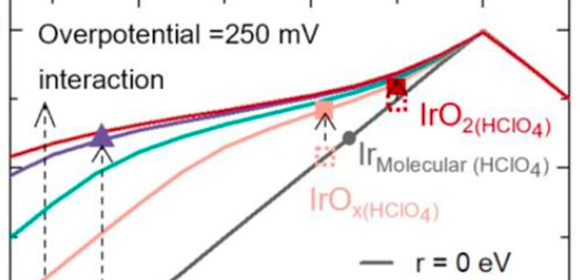
Figura 2: Energie degli stati attivi e loro effetto sulla cinetica intrinseca dell'ossidazione dell'acqua. L'attività relativa di ciascuno stato attivo a un potenziale di 1,48 VRHE e la posizione corrispondente per IrOx in condizioni alcaline e ossidi di iridio amorfi, catalizzatori molecolari rutilo e Ir in condizioni acide (0,1 M HClO4)
Fonte: adattato dal Journal of the American Chemical Society, 2024, DOI: 10.1021/jacs.3c12011
Lo studio, “Il ruolo del pH elettrolitico nell'ossidazione dell'acqua degli ossidi di iridio”, è stato pubblicato sul Journal of American Chemical Society presso DOI: https://doi.org/10.1021/jacs.3c12011.

“Fan zombi sottilmente affascinante. Fanatico della TV. Creatore devoto. Amico degli animali ovunque. Praticante del caffè.”